出生前検査の関連情報
2021-10-12
レクチン法によって採取された胎児赤芽球の検査について
| 検査方法 |
胎児有核細胞の染色体・遺伝子を検査 |
||||
| 型 番 | 母体血から分離・濃縮された胎児赤芽球 |
||||
| 所要日数 |
5~7日程度 |
||||
| 検査時期 |
6週~ | ||||
| 検査内容 |
染色体の数的異常、各種遺伝子疾患 |
||||
| 適応疾患 |
13トリソミー症候群(Patau症候群) 18トリソミー(エドワード症候群) 21トリソミー(ダウン症候群) XXX(トリプルX)症候群 XYY症候群 Klinefelter症候群 Turner症候群 地中海貧血など遺伝子の変異や欠損に基づく障害 |
||||
| 特 徴 |
胎児細胞の採取に流産リスクが伴わない唯一の検査法 |
||||
| 検査限界 |
染色体のモザイクや転座は検出できない |
||||
現状の出生前検査法とその問題点
羊水検査・絨毛検査(侵襲的な確定診断)![]() お腹に針を刺して採取した羊水中の胎児細胞で検査するのが羊水検査です。
お腹に針を刺して採取した羊水中の胎児細胞で検査するのが羊水検査です。![]() 膣から針を刺して採取した絨毛組織の胎児細胞で検査するのが絨毛検査です。
膣から針を刺して採取した絨毛組織の胎児細胞で検査するのが絨毛検査です。![]() これらは侵襲的な胎児細胞の採取法なので、流産や胎児の奇形などを起こすことがあります。
これらは侵襲的な胎児細胞の採取法なので、流産や胎児の奇形などを起こすことがあります。![]() 採取した胎児細胞を培養して全ての染色体の状態を観察できるので、確定診断ができます。
採取した胎児細胞を培養して全ての染色体の状態を観察できるので、確定診断ができます。
母体血清マーカーテスト(非侵襲的確率検査)![]() 妊婦の血液中の数種類のタンパク質濃度を調べます。
妊婦の血液中の数種類のタンパク質濃度を調べます。![]() 通常妊娠の濃度と比較して、ハイリスク妊娠の可能性を予測します。
通常妊娠の濃度と比較して、ハイリスク妊娠の可能性を予測します。![]() 採血で済むので安全ですが、結果が確定しません。
採血で済むので安全ですが、結果が確定しません。![]() ハイリスク妊娠の確率が高いと判定された場合、確定診断が勧められます。
ハイリスク妊娠の確率が高いと判定された場合、確定診断が勧められます。
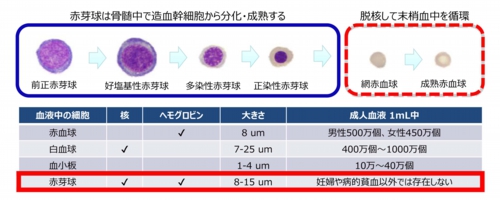
赤芽球とは?
赤芽球(Erythroblast)は、有核赤血球 (Nucleated Red Blood Cell: NRBC)とも呼ばれる未成熟な赤血球です。その核には、胎児の全遺伝情報が保管されています。
胎盤は、母体由来の基底脱落膜と胎児由来の絨毛膜有毛部で構成されています。この胎児の絨毛組織が、母体静脈血で満たされている基底脱落膜に融合して、酸素や栄養の取り込みなどを行っています。絨毛組織では活発な代謝が起こっていて、胎児の絨毛細胞などが分解と再生を繰り返しています。胎児の組織細胞が分解されると、細かく切れたDNAが大量に発生します。このDNA断片が母体静脈血中に入り循環することになります。セルフリーDNAの検査は、この胎児DNA断片を検査対象とします。このような経路を通じて、分解していない絨毛細胞の他、胎児のリンパ球や赤芽球などの血液細胞も母体静脈血に混入します。細胞はDNAよりもはるかに大きなものなので、ごく僅かな数しか細胞として母体血に混入しません。胎児細胞が母体静脈に混入するメカニズムは明確になっていませんが、様々な理由で起こる妊娠高血圧が静脈血中の赤芽球数を増加させることが解っています。
なぜ、赤芽球が胎児の出生前検査のターゲットになるのかというと、それは細胞の寿命に関わっています。例えば、リンパ球は数年の寿命がありますので、母体血中の胎児リンパ球が前の妊娠に由来する、すなわち先に生まれた兄弟のものである可能性が出てきます。赤芽球の寿命は10か月以下ですので、このような心配はありません。
以下に、静脈中に存在する血液細胞のプロフィールを示しますが、大きさや存在頻度などの点で、白血球から赤芽球を分離することが難しいことが解ります。
出生前検査・診断の比較
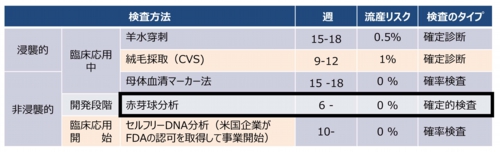
- 検査対象を採取する際、流産リスクが伴う浸襲的診断と、リスクのない非浸襲的診断に大別できる(流産リスクは各統計で異なるので中間的数値を記載)。
- 現状で、実用的な非浸襲的検査は母体血清マーカーテスト。セルフリーDNAによるトリソミー検査も三社が開始。セルフリーDNAの検査精度は血清マーカーテストより高いがコストが10倍以上。
- マーカーテストは染色体異常のリスク率を提示するが、特に偽陰性が問題。マーカーテストやセルフリーDNA検査でハイリスク妊娠と判定されたら羊水検査による確定診断が必要。
- 赤芽球テストは、母体血から胎児赤芽球NRBCを分離・濃縮するので流産リスクがない。
- 胎児赤芽球は胎児の全遺伝子を染色体として提示できるので、非浸襲的検査法としてアドバンテージは高い。分離・濃縮率が高ければDNA解析も可能。
FISH法
クローン化したオリゴヌクレオチドプローブを蛍光標識し、スライドガラスなどにサンプリングした細胞や精子などの染色体と直接ハイブリダイゼーションさせる技術がFluorescence in situ Hybridization (FISH)です。銀を酵素的に発色させるSilver-ISHも、乳がん細胞の検出に積極的に用いられています。ISHの最大の特徴は、染色体の特定の部位を顕微鏡で視覚的に検出することができることです。これは、染色体数の検出のみならず転座やモザイクなどの染色体異常の検出に対して強い武器となります。
また、細胞増殖を制御する遺伝子の変異や融合が、恒常的活性化、すなわち癌化を誘導することが明らかとなっています。近年、一部の肺がん細胞において発生する、2番染色体の微小な転座が報告されました。転座して融合する部位をそれぞれ赤と黄色の蛍光で標識したFISHプローブでハイブリダイズすると、正常の場合、離れたところに赤と黄色の蛍光に基づくスポットシグナルが観察されますが、癌細胞では転座によって赤と黄色が融合した緑のシグナルが観察できます。このような転座の解析法は、新しい癌の検出法として期待されています。
FISH法は、自動化が進んでいるPCR (Polymerase Chain Reaction) によるDNA解析に比べ、職人芸の要素が強い解析法です。基本的なプロセスは、(1)細胞の脱水・固定、(2)界面活性剤などによるエージング、(3)酵素による裸核、(4)固定、(5)被験DNAとプローブの変性、(6)プローブのハイブリダイズ、(7)ハイブリダイズされていないプローブの洗浄、(8)DAPIによる核染色となります。サンプルの状態や細胞の種類に応じて、各工程の条件設定を最適化されることが求められます。
当社では、赤芽球にカスタマイズしたFISH処理法を確立しています。
PCRの原理
PCR(Polymerase chain reaction)法は、現代の分子生物学の進歩に最も貢献した技術の1つです。PCR 法の技術革新と使用される消耗品の低価格化は、これまでの科学技術の進化では考えられないような速さで進んでいます。微量のDNA サンプルから特定の DNA 断片を短時間に大量に増幅して、それを高感度で検出するというのがPCR法の概略です。その操作の簡便さから、現在では、基礎研究のみならず臨床遺伝子診断から食品衛生検査、犯罪捜査に至る幅広い分野に応用されています。
検出法に応じて種々のプロセスがありますが、方法論として汎用のリアルタイムPCR (RT-PCR) 法を例として、以下に示します(詳細は成書やネット上の記事などをご参照ください)。
1. DNAの抽出
使用する試薬メーカーのマニュアルに従って、検査対象となるDNAサンプルを病理組織や単離された細胞から抽出します(抽出しなくても良いPCRもあります)。
2.DNAの増幅
基本的に、①DNAの変性、②アニーリング、③DNAポリメラーゼの反応の繰り返しによって増幅が成就します。
①DNAの変性
- 検出したい特定のDNA断片を増幅させるため、DNAサンプルを入れた反応液を約94℃で熱変性させ、DNAの二本鎖を一本鎖にします。
②アニーリング
- 検出したいDNA断片を増幅するDNAポリメラーゼを作用させるためには、予めプライマー(鋳型DNA)を結合させるアニーリングを行います。一般的に、約55~60℃でDNAサンプルの特定部位にプライマーが相補的に結合します。プライマーの種類によっては、この範囲外の温度が採用されていることもあります。
③ポリメラーゼの反応
- アニーリングによって結合したプライマーの末端にDNAポリメラーゼが反応し、DNAを伸長させ特定断片を複製します。耐熱性DNAポリメラーゼ(Taq Polymerase)で行う場合、約72℃で行います。
以上の工程を専用の装置(サーマルサイクラー)で繰り返すことによって、指数的に特定断片を増幅します。1サイクルにあたり、DNA が2倍に増幅されるので、このサイクルを 22 回行うと、計算上は 100 万倍になります。実際には 30 サイクル程度行いますので、100 万倍から 1000 万倍にまで増幅されることになります。
3.増幅されたDNAの検出
1) インターカレータ-法
- 二本鎖DNAに結合することによって蛍光を発する試薬をPCR 反応系に加える方法です。PCR反応によって複製された二本鎖DNA に結合したインターカレーターは、励起光の照射により蛍光を発します。 この蛍光強度を検出することにより、増幅産物の生成量をモニターします。
2) TaqManプローブ法
- 5′末端を蛍光物質(FAMなど)で、3′末端をクエンチャー物質(TAMRA など)で修飾したオリゴヌクレオチド(TaqManプローブ)をPCR反応系に加える方法です。TaqManプローブは、アニーリングステップでプライマーに特異的にハイブリダイズしますが、プローブ上にクエンチャーが存在するため、励起光を照射しても蛍光の発生は抑制されます。 伸長反応ステップのときに、Taq DNA ポリメラーゼのもつ5′→ 3′エキソヌクレアーゼ活性により、プライマーにハイブリダイズしたTaqManプローブが分解されると、蛍光色素がプローブから遊離し、クエンチャーによる抑制が解除されて蛍光が発せられます。
3) サイクリングプローブ法
- サイクリングプローブ法は、RNAとDNAからなるキメラプローブとRNase Hの組み合わせによる高感度な検出方法です。プローブはRNA部分を挟んで一方が蛍光物質(リポーター)で、もう一方が蛍光を発生させない物質(クエンチャー)で標識されています。このプローブは、切断されていないとクエンチャーの作用によりリポーターが蛍光を発することはありませんが、プローブが増幅産物の相補的な配列とハイブリッドを形成した後にRNaseHでRNA 部分が切断されると、クエンチャーの作用が解除され強い蛍光を発するようになります。この蛍光強度を測定することで、増幅産物の量を見積もることができます。プローブのRNA付近にミスマッチが存在するとRNaseHによる切断は起こりませんので、一塩基の違いも見逃さない非常に特異性の高い検出が可能となります。
PCRの概要
これまでの伝統的なPCRは、そもそも半定量的な手法に基づくものであるとともに、反応が完了したあとで増幅産物を集めて測定するので、増幅プロセスの核酸の量的変化を見積もることが困難な技術でした。
これに対して、RT-PCR(real-time polymerase chain reaction) は、定量PCR(qPCR)とも呼ばれる最も実用的な遺伝子解析技術の一つで、発現遺伝子の定量、遺伝子型のタイピング、一塩基変異の解析(Single Nucleotide Polymorphism)、がん遺伝子の検出、薬効の確認、さらにはRNA干渉の測定などに幅広く利用されています。RT-PCRは、複製されたDNAをその合成反応に相関した蛍光強度としてリアルタイムに測定することに基づきますから、結果的に、細胞や組織のメッセンジャーRNA (mRNA)やマイクロRNA (miRNA)を定量する逆転写も兼ねることになります。このようなDNA/RNAの簡便な定量法は、PCRによる遺伝子解析の用途を飛躍的に拡大させることになりますが、標準物質による検量線が必要となり検出を誤る機会を増やすことになります。
これらと一線を画するPCR法として登場したのが、デジタルPCR(d-PCR)です。このPCRも基本的にはq-PCRですが、定量の絶対性や希少な対立遺伝子の検出には圧倒的な能力を示します。検出対象のDNA断片の数を直接カウントするので、内在の標準遺伝子の増幅や標準物質による検量線に頼らない客観的な定量を実現します。
Digital PCRのプロセス
サーマルサイクラーによる複製産物1分子をマイクロチャンバーやナノリットル/ピコリットルレベルの液滴(ドロプレット)に分取して、TaqManプローブに基づく発色を検出します。チャンバーやドロップレット1単位毎の蛍光発色の有無をデジタリーにカウントするので、絶対的な定量を可能にします。メーカーによっては、2色のプローブで多項目解析を可能にするものもあります。限られた狭い領域での反応となりますので、検出精度が飛躍的に向上します。
赤芽球による出生前検査では、レクチン法を用いたとしても多くて細胞数百個分のゲノムしか提供できないので、d-PCR法はFISH法と共に有力な胎児有核細胞の解析手法になると考えられます。
 [テクノロジー]
[テクノロジー]